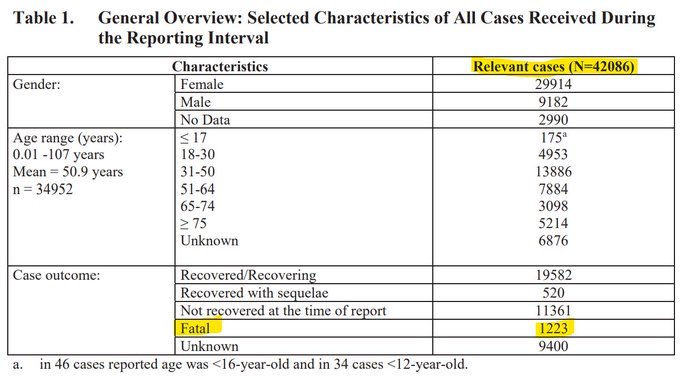
Pfizer fue forzada a liberar los documentos que quería esconder por 70 años y estos muestran que en un período de 3 meses, 1223 de 42 mil murieron después de recibir una inyección, o aproximadamente 1 de cada 35 personas. Esto es el 3{688a8ce96c256f08401d8e2f5c8db48dc2792b622bdd2a5bb1e6509fa5d7b8e2} de mortalidad.
Documentos de Pfizer – Salud pública y profesionales médicos por la transparencia (phmpt.org)
Además
El fabricante de vacunas Pfizer retiró el mes pasado la solicitud de autorización de uso de emergencia (EUA) para su vacuna contra el coronavirus de Wuhan (COVID-19) en la India. La retirada de la firma con sede en Nueva York siguió a su negativa a realizar un ensayo de seguridad nacional para su vacuna, que el regulador de medicamentos de la India requería.
Pfizer decidió rescindir su solicitud de EUA en India durante una reunión el 2 de febrero con la Organización Central de Control de Estándares de Medicamentos (CDSCO), la agencia reguladora del país. CDSCO ordenó al gigante farmacéutico que realice un ensayo local en India “para determinar si la vacuna es segura y genera una respuesta inmune adecuada en los ciudadanos”.
Según el regulador, el ensayo es un requisito previo antes de que se pueda otorgar una EUA a la vacuna BNT162b2 de Pfizer, realizada en asociación con la compañía alemana BioNTech.
El Dr. Vinod K. Paul, jefe del Grupo Nacional de Expertos en Administración de Vacunas de la India para COVID-19, dijo que se necesita un “ensayo puente” para vacunas extranjeras como la de Pfizer antes de recibir la aprobación. Explicó que los ensayos puente son importantes, ya que sirven para determinar qué tan seguras y efectivas son las vacunas cuando se inyectan en poblaciones con una composición genética diferente a la de las naciones occidentales.
Pfizer solicitó una exención de este ensayo puente. Citó evidencia de aprobaciones de EUA BNT162b2 recibidas en otros países, que se basaron en ensayos clínicos realizados en los Estados Unidos y Alemania. A pesar de la presencia de disposiciones que permiten que los ensayos puente de vacunas sean eximidos en ciertas circunstancias, CDSCO optó por no otorgar a Pfizer una exención.
El regulador señaló efectos adversos graves relacionados con la vacuna COVID-19 de Pfizer, y agregó que “se está investigando la causalidad de [estos] eventos con la vacuna”. Continuó: “La firma no ha propuesto ningún plan para generar datos de seguridad e inmunogenicidad en [la] población india. Después de una deliberación detallada, [CDSCO] no ha recomendado la concesión de permiso para el uso de emergencia [de la vacuna de Pfizer] en el país en esta etapa”. (Relacionado: Médico querido en la India sucumbe al coronavirus a pesar de estar completamente vacunado.)
Vacuna de Pfizer fuera, otras vacunas en
Aparte de los graves efectos adversos relacionados con la vacuna y la negativa de Pfizer a realizar un ensayo de vacuna local, India también consideró que la vacuna BNT162b2 no era adecuada para el país debido a su estricto requisito de temperatura.
Funcionarios del Ministerio de Salud y Bienestar Familiar de la India dijeron que la vacuna COVID-19 de Pfizer no es la mejor opción para el país. Requiere una temperatura de almacenamiento de -70 grados Celsius (-94 grados Fahrenheit), de lo que solo los congeladores caros son capaces de hacer. Tales congeladores no están fácilmente disponibles en la India.
Pfizer confirmó la decisión de rescindir su solicitud de EUA en un comunicado a Reuters. “Sobre la base de las deliberaciones en la reunión y nuestra comprensión de la información adicional que el regulador [de medicamentos indios] puede necesitar, la compañía ha decidido retirar su solicitud en este momento. Pfizer continuará colaborando con la autoridad y volverá a presentar su solicitud de aprobación con información adicional a medida que esté disponible en un futuro próximo”.
El fabricante del medicamento originalmente solicitó la autorización para la vacuna BNT162b2 en la India a fines de 2021. El gobierno indio aprobó las solicitudes de EUA para dos vacunas candidatas posteriores: la vacuna CoviShield fabricada por AstraZeneca y la Universidad de Oxford, y la vacuna candidata local Covaxin por Bharat Biotech y el Consejo Indio de Investigación Médica.
Otro fabricante de vacunas de cosecha propia se unió a la lista de posibles candidatos a vacunas covid-19. Dr. Reddy’s Laboratories ha estado llevando a cabo una prueba puente para una versión local del disparo ruso Sputnik V, apodado como Sputnik Light. La compañía, con sede en el estado indio de Telangana, está a cargo de la fabricación de la vacuna de dosis única, con la aprobación para uso de emergencia en proceso.